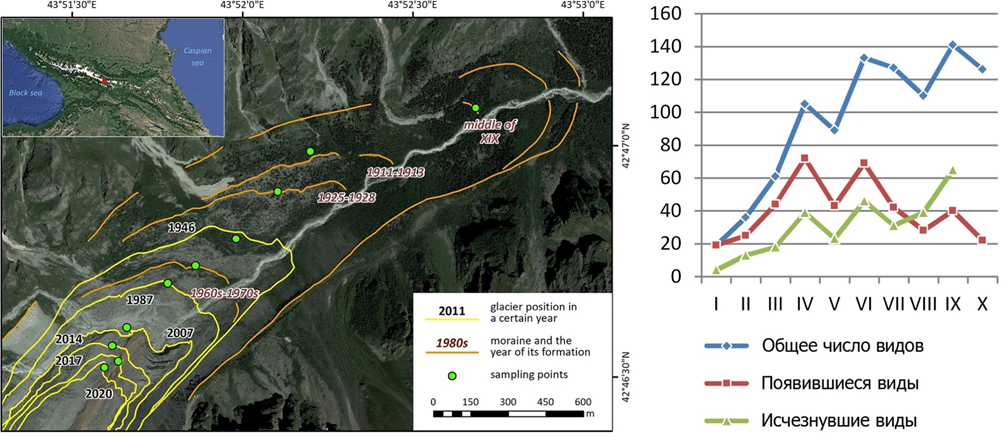
1. Площадь ледников Кавказа за последние 20 лет сократилась на 23%, что может вскоре привести к вымиранию холодолюбивых видов и к сильным смещениям зоны их обитания. Впервые в России на хорошо датированных поверхностях (ИГ РАН), появившихся после отступания ледников Центрального Кавказа (Цейский, Безенги, Кашкаташ), изучены сукцессии беспозвоночных животных на протяжении последних 150−170 лет. Установлено, пионерный комплекс видов во многом сходен с супрагляциальным сообществом, существующем на поверхности самого ледника. Таксономическое разнообразие большинства групп со временем последовательно возрастает, но сукцессия сообщества следует заместительной (а не дополняющей) модели, когда население животных кардинально преобразуется на каждом этапе смены типа растительности (пустошь – луг – кустарниковые заросли – лес). При этом темпы сукцессии в течение лесной фазы замедляются (Рис. 1). Из 438 обнаруженных видов, 30 оказались новыми для науки, а эндемики Кавказа были многочисленны на всех стадиях сукцессии. Оспорены классические принципы первичных сукцессий – «predator first paradox principle» (Hodkinson et al. 2001, 2002) и «Collembola first principle» (Hågvar et al. 2020; Hågvar and Gobbi 2022), поскольку целый ряд крупных таксонов и трофических групп появляются на молодых поверхностях почти одновременно и очень быстро.
Публикации: Makarova O.L., Antipova M.D., Babenko A.B., Bushueva I.S., Chulei A.D., Golovatch S.I., Doroshina G.Ya., Kolesnikov V.B., Mazei Yu.A., Makarov K.V., Palatov D., Ponomarev A.V., Popov K.P., Rapoport I.B., Semionenkov O.S., Snegovaya N.Y., Sheftel B.I., Tsyganov A.N., Turbanov I.S., Zuev R.V. 2024. Successions of terrestrial invertebrate communities during the Tsey Glacier retreat, Central Caucasus // Caucasiana. No 3. P. 41–87. DOI: 10.3897/caucasiana.3.e117332 [РИНЦ]
Marin I.N., Palatov D.M. 2024. The diversity of freshwater stygobiotic crustaceans in the republic of North Ossetia–Alania provides new evidence for the existence of an ancient glacial refugium in the North Caucasus region // Water. Vol. 16, no. 9. P. 1212–1212. https://doi.org/10.3390/w16091212 [Q1, Scopus]
Makarchenko E.A., Semenchenko A.A., Palatov D.M. 2024. Smittia solominae sp. nov. (Diptera: Chironomidae: Orthocladiinae), living on ice of high mountain glaciers of the Elbrus region (North Caucasus) // Zootaxa. Vol. 5415, no. 4. P. 561–569. https://doi.org/10.11646/zootaxa.5415.4.5 [Q2, Scopus]
Shveenkova Y.B., Antipova M.D., Babenko A.B. 2024. Nine new species of the genus Oligaphorura Bagnall 1949 (Collembola, Onychiuridae) from Russia // Зоологический журнал. Т. 103. №. 1. С. 8–32. doi: 10.31857/S0044513424010029 [Q4, Scopus]
Striuchkova A.V., Antipova M.D., Potapov M.B., Semenova D.A., Kuznetsova N.A. 2024. Distribution of genetic lineages of Parisotoma notabilis sensu lato (Collembola) in Eastern Europe and the Caucasus: new lineages and morphological differences // Soil Organisms. Vol. 96, no 1. P. 23–36. doi: 10.25674/356
Makarchenko E. A., Palatov D.M. 2024. Redescription of the caucasian endemic Diamesa tskhomelidzei Kownacki et Kownacka (Diptera: Chironomidae: Diamesinae) // Zootaxa. Vol. 5419, no. 3. P. 446–450. https://doi.org/10.11646/zootaxa.5419.3.9 [Q2, Scopus]
Teslenko V.A., Palatov D.M., Semenchenko A.A. 2024. Overview of the caucasian Perla Geoffroy, 1762 (Plecoptera: Perlidae) based on morphological and molecular data with description of two new species // Zootaxa. Vol. 5507, no. 1. P. 1–56. https://doi.org/10.11646/zootaxa.5507.1.1 [Q2, Scopus]
Makarchenko E.A., Semenchenko A.A., Palatov D.M. 2024. Morphological description and DNA barcoding of Diamesa achipseensis sp. nov. (Diptera: Chironomidae: Diamesinae) from southwestern Caucasus // Zootaxa. Vol. 5481, no. 4. P. 477–482. https://doi.org/10.11646/zootaxa.5481.4.6 [Q2, Scopus]
2. Вопреки ожиданиям, таксономическое разнообразие литоральных клещей Каспия (самой разнообразной группы животных на морских берегах) оказалось резко обедненным, состоящим только из банальных голарктических или европейских видов, представленных самыми ординарными гаплотипами. При этом эндемизм морской фауны Каспия достигает в отдельных группах 60–80%, а почвенные и стигобионтные комплексы беспозвоночных морских террас содержат многочисленные новые, эндемичные и реликтовые виды. Выдвинуто предположение, что постоянная нестабильность береговой линии Каспия, даже в наше время мелеющего на 25–30 см в год, при отсутствии настоящей приливно-отливной зоны, и ранее препятствовала обособлению новых и сохранению редких таксонов литоральной фауны.
Публикации: Makarova O.L., Kazemi S. 2024. A new species of Antennoseius from the Caspian region and the species composition of the oudemansi-group (Acari, Mesostigmata, Ascidae) // Systematic & Applied Acarology. Vol. 29, no 7. P. 811–830. [Q1, Scopus]
Andrianov B.V., Makarova O.L., Goryacheva I.I. 2024. Genetic variability of abundant littoral species of mesostigmatic mites (Acari, Mesostigmata) with different distributions from the seashores of Eurasia // Acarologia. Vol. 64, no 4. P. 1191–1212. [Q2, Scopus]
Makarchenko E.A., Semenchenko A.A., Palatov D.M., Lisanovskaya E.A. 2024. Morphological description and DNA barcoding of Thalassomya paraskevae sp.nov. (Diptera: Chironomidae: Telmatogetoninae) from coast of the Black Sea // Zootaxa. Vol. 5481, no. 4. P. 477–482. https://doi.org/10.11646/zootaxa.5501.4.2 [Q2, Scopus]
Kolesnikov V.B., Klimov P.B., Khaustov A.A., Makarova O.L. 2024. A new arenicolous species of the genus Thyreophagus (Acari: Acaridae) from the Caspian Sea coast: Taxonomy and ecological insights. Zootaxa. In press. [Q2, Scopus]
3. Суммарно описано 39 новых для науки видов почвенных, водных и амфибиотических беспозвоночных: 1 Clitellata, 3 Gastropoda, 12 Collembola, 13 Crustacea, 5 Arachnida, 5 Insecta. На Кавказе и в Поволжье обнаружены доледниковые рефугиумы стигобионтной фауны. Проведены таксономические региональные ревизии трех родов членистоногих и проанализированы фауногенетические процессы пресноводных губок Восточной Европы и моллюсков-прудовиков Берингии.
Teslenko V.A., Palatov D.M., Semenchenko A.A. 2024. Overview of the caucasian Perla Geoffroy, 1762 (Plecoptera: Perlidae) based on morphological and molecular data with description of two new species //Zootaxa. Vol. 5507, no 1. P. 1-56. https://doi.org/10.11646/zootaxa.5507.1.1[Q2, Scopus]
Sokolova A.M., Palatov D.M., Itskovich V.B. 2024. Latitudinal distribution of freshwater sponge species across European Russia // Zoologischer Anzeiger. Vol. 311. P. 88-96. https://doi.org/10.1016/j.jcz.2024.06.004[Q1, Scopus]
Palatov D.M., Chertoprud E.M. 2024. A new stygobiotic species of the genus Proasellus Dudich, 1925 (Crustacea: Isopoda: Asellidae) from the Black sea coast of the Caucasus // Invertebrate Zoology. Vol. 21, no 3. P. 369-383. https://doi.org/10.15298/ invertzool.21.3.09 [Q1, Scopus]
Novikov A.A., Sharafutdinova D.N., Mayor T.Y., Chertoprud E.S. 2024. A New Species of Diacyclops (Copepoda, Cyclopoida) from the D. crassicaudis (Sars, 1863) Species Group with Critical Taxonomy Remarks //Diversity. Vol. 16, no 4. P. 208. https://doi.org/10.3390/d16040208 [Q1, Scopus]
Fefilova E. B., Novikov A. A., Chertoprud E.S. 2024. A new species of the genus Moraria T. Scott et A. Scott, 1893 (Copepoda: Harpacticoida) from Russian Arctic // Artropoda Selecta. Vol. 33, no 1. P. 53-64. https://doi.org/ 10.15298/arthsel.33.1.05 [Q2, Scopus]
Nekhaeva A.A., Kim L.V., Yeszhanov A.B. 2024. New data on the spider fauna (Arachnida, Aranei) of the East Kyzylkum Desert, Kazakhstan // Arthropoda Selecta. Vol. 33, no 3. P. 391–405. https://doi.org/ 10.15298/arthsel.33.3.08 [Q2, Scopus]
Aksenova O.V., Vinarski M.V., Itagaki T., Ohari Y., Oshida T., Kim S.K., Lee J.H., Kondakov A.V., Khrebtova I.S., Soboleva A.A., Travina O.V., Sokolova S.E., Palatov D.M., Bespalaya Y.V., Vikhrev I.V., Gofarov M.Yu., Bolotov I.N. 2024. Taxonomy and trans-beringian biogeography of the pond snails (Gastropoda: Lymnaeidae) of East Asia: an integrative view // Zoological Journal of the Linnean Society. Vol. 201, no 4. zlae083. https://doi.org/ 10.1093/zoolinnean/zlae083 [Q1, Scopus]
Dózsa-Farkas K., Makarova O. 2024. A new species of the enchytraeid genus Mesenchytraeus Eisen, 1878 (Clitellata, Enchytraeidae) from the eastern Chukot Peninsula, Russian Far East, as further evidence of former trans-Beringian faunal connections // Zootaxa. In press. [Q2, Scopus]

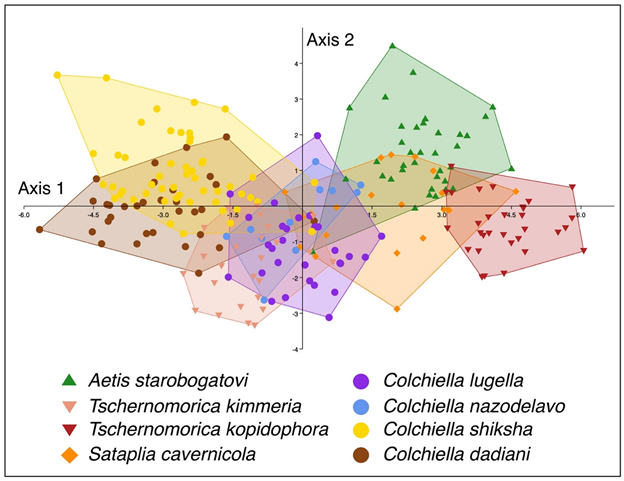
4. Установлено, что перигляциальные поверхности приполярной суши обоих полушарий, как и новые территории, образовавшиеся на месте отступания горных ледников, населяют преимущественно одни и те же группы членистоногих, среди которых наиболее обычны тонкопокровные представители семейств Nanorchestidae, Eupodidae, Brachychthoniidae (Acari), Isotomidae (Collembola) и Chironomidae (Insecta). Самый молодой на Земле биом полярных пустынь и пионерные поверхности бывшего ложа ледников населяют, таким образом, наиболее древние группы животных, ведущих свое начало с девона (микроартроподы) или триаса (комары-звонцы), в питании которых большую роль играют биопленки, формирующиеся на минеральных частицах. Получены доказательства ведущей роли аэропланктона в заселении ими холодных пионерных субстратов.
Исполнители: О.Л. Макарова, Д.М. Палатов, А.Б. Бабенко, М.Д. Антипова, Зав. лаб. – О.Л. Макарова
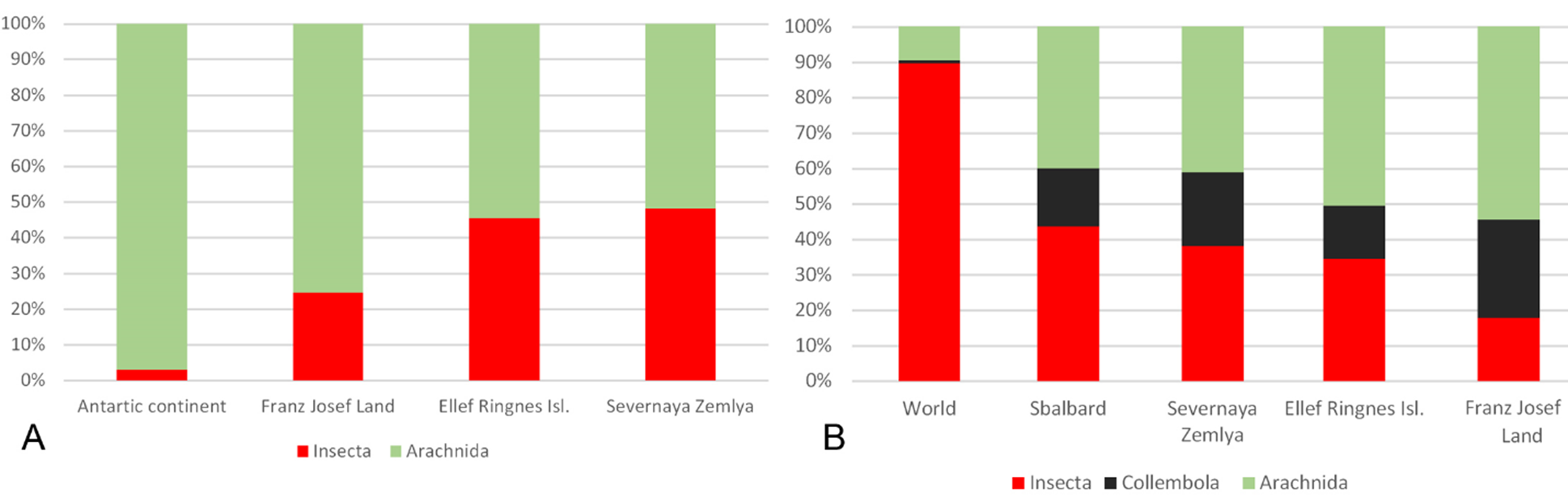
Makarova O.L. 2023. Free-living mites (Acari) of the Franz Josef Land Archipelago, the coldest Old World territory: diversity, geographic distributions, assemblages // Acarologia. V. 63. № 4. P. 1163–1186. https://doi.org/10.24349/p6wb-pcni
Антипова М. Д., Бабенко А.Б., 2023. Формирование сообществ коллембол (Hexapoda, Collembola) при отступании Цейского ледника (Северная Осетия-Алания) // Зоологический журнал. Т. 102, № 12, с. 1–19. https://doi.org/10.31857/S0044513423120036
Makarchenko E.A., Semenchenko A.A., Palatov D.M. 2023. Fauna and taxonomy of Diamesinae (Diptera, Chironomidae) from the Caucasus, with a morphological description and DNA barcoding of new taxa and a discussion of diagnostic problems for Diamesa Meigen and Pseudodiamesa Goetghebuer // Zootaxa. V. 5271. № 2. P. 313–328.
5. Описана смена комплексов доминирующих видов в сообществах разных экологических групп организмов при развитии термокарстового тундрового водоема. Обосновано, что последовательная смена типов сообществ является первичной сукцессией. Выявлено, что для раковинных амеб и микроракообразных с короткими жизненными циклами значимы факторы среды, изменчивые на временных интервалах от месяцев до лет. Для макробеспозвоночных с длительным развитием ключевые факторы среды варьировали в диапазоне года и более. Предположено, что первые изменения экосистемы под действием глобальных климатических изменений будут проявляться на сообществах зоопланктона, микро- и мейобентоса, как более чувствительных к кратковременным изменениям среды.
Опубликовано: Chertoprud E.S., Novichkova A.A., Tsyganov A.N., Vorobjeva L.V., Esaulov A.S., Krylenko S.V., Mazei Y.A. 2023. Species Diversity and Driving Factors of Benthic and Zooplanktonic Assemblages at Different Stages of Thermokarst Lake Development: A Case Study in the Lena River Delta (Middle Siberia) // Diversity. V. 15. №4. P. 511. https://doi.org/10.3390/d15040511
6. В нижнем течении и устьевой зоне реки Дон обнаружен уникальный рефугиум доледниковой древнепресноводной фауны. Исследованы и описаны населяющие его территорию ракообразные отряда Amphipoda. Новые, локально распространенные виды в составе эндемичных кавказских родов Diasynurella и Pontonyx, а также в составе общеевропейских Niphargus и Cryptorchestia, были найдены в родниках и грунтовых водах бассейна реки Кизитеринка, протекающей через город Ростов-на-Дону. Суммарно описано четыре новых для науки вида. Молекулярные данные подтверждают их долгосрочную изоляцию, начиная, по крайней мере, с Плиоцена. Это первый явно очерченный равнинный рефугиум пресноводной фауны, обнаруженный и описанный с территории Предкавказья и Приазовья. Ранее считалось, что в ледниковые эпохи древняя фауна этих мест вымерла и в дальнейшем была замещена широкораспространенными общеевропейскими видами. Наши данные свидетельствуют о том, что фрагментарно и локально эта уникальная фауна сохранилась.
Palatov D.M., Marin I.N. 2023. Diversity of the caucasian genus Diasynurella Behning, 1940 (Amphipoda: Crangonyctidae) with description of four new species // Arthropoda Selecta. V.32. № 1. P. 23–55. doi: 10.15298/arthsel.32.1.03
Marin I.N., Palatov D.M. 2023. A new semi-terrestrial Cryptorchestia Lowry et Fanini, 2013 (Amphipoda: Talitridae) from the southwestern Caucasus and the Ciscaucasian plain // Arthropoda Selecta. V. 32. № 3. P. 281–292. doi:10.15298/arthsel.32.3.05
Marin I.N., Palatov D.M. 2023. A revision of the genus Pontonyx Palatov et Marin, 2021 (Amphipoda: Crangonyctidae), with an overview of crangonyctid diversity in the Palaearctic // Arthropoda Selecta, V.32. № 2. P. 173–196. doi: 10.15298/arthsel.32.2.04
Marin I.N. Palatov D.M. 2023. Insights on the existence of ancient glacial refugee in the northern Black/Azov sea lowland, with the description of the first stygobiotic microcrustacean species of the genus Niphargus Schiödte, 1849 from the mouth of the Don River // Diversity. V. 15. № 5. 682. doi:10.3390/d15050682
7. Сформулированы принципы формирования Красных книг как инструмента сохранения сукцессионной системы региона:
а) система объектов животного и растительного мира, занесённых в ту или иную Красную книгу, должна соответствовать сукцессионной системе, актуальной в регионе действия данной Красной книги;
б) места обитания занесённых в Красную книгу видов животных и растений должны охватывать сообщества организмов разного ранга, функциональные блоки и уязвимые комплексы региональной сукцессионной системы;
в) промежуточные стадии сукцессии целесообразно поддерживать не консервационно, искусственным торможением сукцессии, а ротационно, когда завершение той или иной стадии сукцессии на одном участке сопровождается достижением той же стадии сукцессии на топологически близком участке;
г) фрагментация природного покрова и уменьшение характерного размера местообитаний снижает хорологический класс вида, при котором возникает риск потери жизнеспособности его популяций.
На примере насекомых, занесённых в Красную книгу Московской области, показано, что в совокупности их местообитания значительно (но не полностью) охватывают разнообразие естественных экосистем в регионе. Одним из препятствий является недостаточно изученная динамика растительных сообществ и не до конца разработанная их классификация.
Опубликовано: Соболев Н.А., Волкова Л.Б. Красная книга как инструмент защиты экосистем в эпоху антропоцена // Использование и охрана природных ресурсов в России. 2023. №2. С. 13-18. https://istina.msu.ru/publications/article/612726634/
