
В "Русском орнитологическом журнале" вышла статья Н.Б. Конюхова, А.Е. Дмитриева, С.М. Артемьевой и М.С.Мамаева. В статье "Заметки о морских птицах прибрежных вод Аргентины" представлены данные, собранные во время 79-го рейса научно-исследовательского судна «Академик Мстислав Келдыш» Российской Академии наук на юге Атлантического океана от акватории залива Ла-Плата до траверза пролива Бигль. Корабль вышел из порта Монтевидео 8 января 2020 поздним вечером; учёты птиц на этом этапе экспедиции велись с 9 по 15 января 2020.
Наблюдения за птицами проводились в течение всего светлого времени суток. Смена наблюдателей происходила в 8, 12, 16 и 20 ч, т.е. была привязана к смене вахт на корабле. Продолжительность первого периода, с рассвета до 8 ч, и последнего, с 20 ч до заката, зависела от широты, на которой находилось судно, и день ото дня увеличивалась. Птицы наблюдались с верхней (пеленгаторной) палубы судна, однако при скорости ветра 17-19 м/с и выше или в дождь наблюдатели перемещались на мостик. В обоих случаях два наблюдателя стояли у левого и правого бортов судна и фиксировали в 400-метровой полосе всех птиц, их число, видовую принадлежность, характер поведения и направление полёта. Сектор наблюдения для каждого учётчика составлял 90° по ходу движения судна. Всех встреченных птиц, видовое определение которых вызывало затруднение в полевых условиях, мы, по возможности, старались фотографировать фотокамерами, снабжёнными телеобъективами. Это позволило позднее конкретизировать их видовую принадлежность. Маршрут судна фиксировался с помощью GPS навигатора.
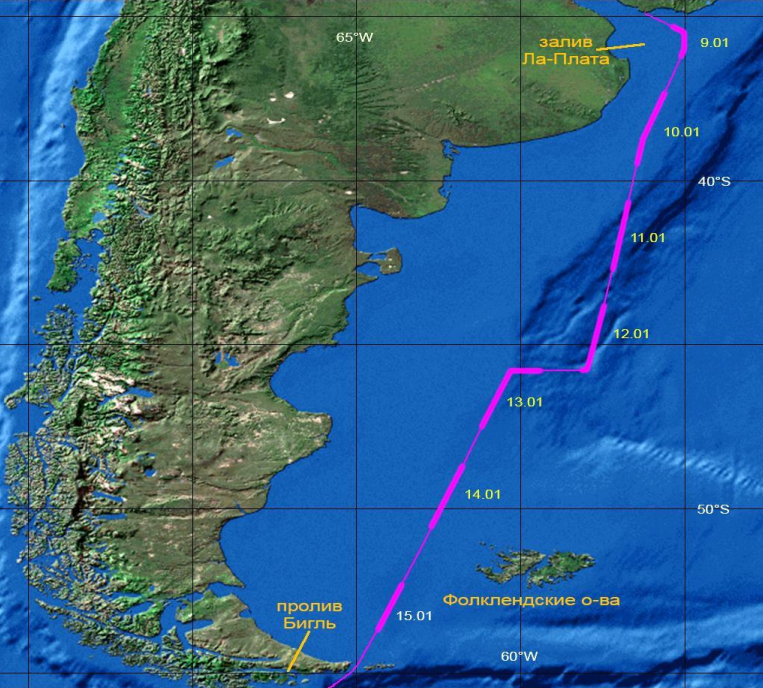
Рис. 1. Схема маршрута экспедиции. Утолщённая линия – светлое время суток, в течение которого проводились наблюдения в указанные рядом даты 2020 года.
Использована систематика птиц Дж.Клементса с соавторами (Clements еt al. 2017). Русские названия приведены по: Волков, Коблик 2018, с незначительными изменениями. Порядок расположения отрядов, семейств и видов неворобьиных дан по: Волков, Коблик 2018.
Видовой состав встреченных птиц и субъективная оценка их численности приведены в таблице.
Полный список видов птиц, зарегистрированных в прибрежных водах Южной Атлантики в январе 2020 года с указанием субъективной оценки численности: O – единственная встреча; R – редок; U – малочислен; C – обычен или многочислен; значком «f» отмечены виды, по которым имеется подтверждающие фото.
| № | Вид | Монтевидео – Бигль |
| Отряд Пингвинообразные Sphenisciformes | ||
| Семейство Пингвиновые Spheniscidae | ||
| 1 | Пингвин-скалолаз Eudyptes chrysocome | Of |
| Отряд Буревестникообразные Procellariiformes | ||
| Семейство Южные качурки Oceanitidae | ||
| 2 | Качурка Вильсона Oceanites oceanicus | Cf |
| Семейство Альбатросовые Diomedeidae | ||
| 3 | Странствующий альбатрос Diomedea exulans | Cf |
| 4 | Южный королевский альбатрос Diomedea epomophora | Rf |
| 5 | Северный королевский альбатрос Diomedea sanfordi | Of |
| 6 | Светлоспинный альбатрос Phoebetria palpebrata | Rf |
| 7 | Чернобровый альбатрос Thalassarche melanophris | Cf |
| 8 | Желтоклювый альбатрос Thalassarche chlororhynchos | Uf |
| Семейство Буревестниковые Procellariidae | ||
| 9 | Южный гигантский буревестник Macronectes giganteus | Cf |
| 10 | Северный гигантский буревестник Macronectes halli | Cf |
| 11 | Капский голубок Daption capense | Rf |
| 12 | Голубой буревестник Halobaena caerulea | Of |
| 13 | Антарктический прион Pachyptila desolata | Cf |
| 14 | Тонкоклювый прион Pachyptila belcheri | Cf |
| 15 | Атлантический тайфунник Pterodroma incerta | Rf |
| 16 | Мягкопёрый тайфунник Pterodroma mollis | Cf |
| 17 | Белогорлый буревестник Procellaria aequinoctialis | Cf |
| 18 | Серый буревестник Ardenna grisea | Rf |
| 19 | Пестробрюхий буревестник Ardenna gravis | Uf |
| Отряд Ржанкообразные Charadriiformes | ||
| Семейство Бекасовые Scolopacidae | ||
| 20 | Плавунчики Phalaropus sp. | O |
| Семейство Чайковые Laridae | ||
| 21 | Магелланова чайка Leucophaeus scoresbii | Of |
| 22 | Речная крачка Sterna hirundo | Of |
| Семейство Поморниковые Stercorariidae | ||
| 23 | Чилийский поморник Stercorarius chilensis | Of |
| 24 | Антарктический поморник Stercorarius antarcticus | Of |
| 25 | Короткохвостый поморник Stercorarius parasiticus | Of |
Пингвин-скалолаз Eudyptes chrysocome (Forster, 1781). Около полумиллиона пар гнездится на островах южного Чили и Аргентины, а также на Фолклендских островах. Нами два одиночных пингвина этого вида встречены 14 января северо-западнее Фолклендских островов.
Качурка Вильсона Oceanites oceanicus (Kuhl, 1820). Гнездится на скалах и в осыпях на субантарктических островах от мыса Горн на восток до архипелага Кергелен, а также на побережье Антарктиды. Она кормится в холодных водах над континентальным шельфом. Этот вид встречался в течение всего маршрута с 10 до 15 января 2020. Обычно это были одиночные птицы (рис. 2), но встречались и скопления до 4 птиц. Всего нами встречено 55 особей.

Рис. 2. Качурка Вильсона Oceanites oceanicus. Фото Н.Б.Конюхова.
Белоспинные альбатросы рода Diomedea: королевские и странствующий – виды, которые достаточно трудно определять на большом расстоянии в полевых условиях. Половой зрелости птицы этих видов достигают в возрасте 6-12 лет. По мере взросления они меняют несколько нарядов. С каждой линькой птицы становятся всё светлее и светлее. Из-за большой возрастной и индивидуальной изменчивости окраски оперения определять видовой статус этих птиц в поле крайне сложно, поскольку, например, окраска оперения некоторых возрастов странствующего и южного королевского альбатросов может быть сходной. Видоспецифический признак обоих видов королевских альбатросов – чёрный цвет режущей кромки надклювья. Согласитесь, на расстоянии рассмотреть этот признак в полевых условиях крайне сложно. Северный же королевский альбатрос отличается от южного, помимо полностью чёрной окраски крыльев сверху, ещё и тёмной передней кромкой пропатагиальной складки крыла. В некоторых случаях даже на фото, которое сделано с небольшого расстояния, не просто отнести птиц к тому или другому виду. Однако благодаря хорошей фотооптике и последующему тщательному анализу сделанных фотографий нам удалось определить до вида подавляющее большинство встреченных птиц.

Рис. 3. Странствующий альбатрос Diomedea exulans. Фото Н.Б.Конюхова.
Странствующий альбатрос Diomedea exulans Linnaeus, 1758. Этот вид встречается циркумполярно. На острове Южная Георгия гнездится около 18% мировой популяции, насчитывающей примерно 8050 пар (ACAP 2009а). Странствующие альбатросы были самыми многочисленными среди белоспинных альбатросов и встречались в течение всего маршрута в прибрежной акватории Южной Америки, но более многочисленными они были от начала маршрута (37°30' ю.ш.) и примерно до 45° ю.ш. Разово наибольшее число странствующих альбатросов было отмечено 15 января 2020 в 8:00, когда одновременно вокруг судна кружило 9 птиц; всего на этом участке экспедиции встречены 58 странствующих альбатросов. Это были как взрослые (рис. 3), так и неполовозрелые птицы.
Южный королевский альбатрос Diomedea epomophora Lesson, 1825. Популяция южного королевского альбатроса на острове Кэмпбелл оценивалась в 7800 гнездящихся пар, что составляет 99% от общей популяции. Неразмножающиеся птицы кормятся у западного и восточного побережья Южной Америки (Moore, Bettany 2005), как правило, между 30 и 55° ю.ш. (ACAP 2009б). По фотографиям птиц, сделанным с небольшого расстояния, можно сказать, что южные королевские альбатросы (рис. 4) были достаточно обычны на нашем маршруте между 37 и 45° ю.ш. Дальше на юг, в акватории западнее Фолклендских островов, встречена всего 1 птица. Всего встречено 11 этих альбатросов.

Рис. 4. Южный королевский альбатрос Diomedea epomophora. Фото Н.Б.Конюхова.
Северный королевский альбатрос Diomedea sanfordi (Murphy, 1917). На архипелаге Чатем гнездится около 99% всей популяции, что составляет около 7 тыс. пар. Неудачно размножавшиеся птицы, неполовозрелые особи, в том числе и слётки, пересекают Тихий океан, достигая шельфа Южной Америки, и по нему мигрируют от Чили к Патагонскому шельфу. На Патагонском шельфе северные королевские альбатросы встречаются на расстоянии 200-350 км от берега в водах глубиной менее 200 м, но между 36 и 49° ю.ш. могут сдвигаться в сторону континентального склона до глубины 1000 м (ACAP 2009в).
Как уже упоминались (Конюхов и др. 2020) одна птица встречена 14 января на широте 51°34' ю.ш. к северо-западу от Фолклендских островов. Однако тщательный просмотр фотоматериала отснятого на этом участке маршрута выявил ещё взрослого северного королевского альбатроса (рис. 5), встреченного в прибрежных водах Южной Америки 11 января на широте 42°49' ю.ш., и молодую птицу, предположительно относящеюся к этому виду, 12 января на широте 45°48' ю.ш.

Рис. 5. Северный королевский альбатрос Diomedea sanfordi. Фото С.М. Артемьевой.
Светлоспинный альбатрос Phoebetria palpebrata (J.R.Forster, 1785). В Южном океане этот альбатрос встречается циркумполярно. Общая численность вида оценивается в 87 тыс. особей, включая 19- 24 тыс. пар репродуктивной части популяции (Croxall, Gales 1998). Молодые альбатросы возвращаются в колонии через 7-12 лет после слёта (ACAP 2009г). В районе исследований на острове Южная Георгия гнездится около 5 тыс. пар. При удачном сезоне размножения светлоспинные альбатросы гнездятся раз в два года. Нам эти альбатросы встречались от 36°15' ю.ш до 37°06' ю.ш. Обычно отмечали одиночных птиц (рис. 6) и только 11 января, когда птицы из-за сильного ветра учитывались только в кильватере, отмечено 5 и 2 особей в 17:00 и 18: 00, соответственно. Всего на этом участке маршрута встречено 13 особей.

Рис. 6. Светлоспинный альбатрос Phoebetria palpebrata. Фото Н.Б.Конюхова.

Рис. 7. Чернобровый альбатрос Thalassarche melanophris. Фото Н.Б. Конюхова.
Чернобровый альбатрос Thalassarche melanophris (Temminck, 1828). Чернобровые альбатросы встречаются циркумполярно от субтропических до полярных вод. Общая численность размножающейся популяции оценивается примерно в 70 тыс. пар, из которых около 72% гнездится на Фолклендских островах и 8% на Южной Георгии (Poncet et al. 2006; Wolfaardt 2012). Чернобровые альбатросы были самыми обычными и многочисленными альбатросами от прибрежной акватории Ла-Платы до пролива Бигль. Обычно они отмечались поодиночке (рис. 7) или по 2-3 особи, и только раз встречено скопление в 11 особей. Нами встречены как взрослые, так и неполовозрелые птицы, причём, чем южнее, тем меньше становилось молодых птиц. Чернобровые альбатросы часто сопровождали судно. Всего было встречено 395 особей.

Рис. 8. Желтоклювый альбатрос Thalassarche chlororhynchos. Фото Н.Б.Конюхова.
Желтоклювый альбатрос Thalassarche chlororhynchos (Gmelin, 1789). Гнездится на архипелаге Тристан-да-Кунья. Размножающаяся часть популяции оценивается в 35-73 тыс. особей. Вне сезона размножения эти альбатросы разлетаются по всей Южной Атлантике, но в основном встречаются между 25° и 50° ю.ш.; птицы отмечаются у побережья Аргентины, Бразилии и западного побережья южной части Африки (Harrison 1983). Нами желтоклювые альбатросы встречены с начала маршрута в устье залива Ла-Плата и примерно до 45° ю.ш., но наиболее многочисленными они были только до 39°30' ю.ш. Обычно наблюдались одиночные особи (рис. 8), восемь раз одновременно встречены по две и только раз – три особи. Всего на этом участке маршрута встречено 47 желтоклювых альбатросов.

Рис. 9. Южный гигантский буревестник Macronectes giganteus. Фото Н.Б.Конюхова.

Рис. 10. Северный гигантский буревестник Macronectes halli. Фото Н.Б. Конюхова.
Оба вида гигантских буревестников рода Macronectes, южный и северный, обитают в Антарктике и Субантарктике, где их ареалы значительно перекрываются. Определение этих видов в полевых условиях затруднено. Подробный анализ определительных признаков дан в нашей предыдущей публикации (Конюхов и др. 2020). Как и прежде, для видовой идентификации мы использовали единственный надёжный признак, указанный в справочной литературе – цвет конца надклювья (Harrison 1983; Shirihai 2008; Narosky, Yzurieta 2010); у южного гигантского буревестника ноготок рамфотеки maxillary unguis зеленоватый, а у северного гигантского буревестника – коричневатый или красноватый. Оба вида регулярно сопровождали судно, вокруг которого порой кружило до 30 особей. Всего же в течение этого участка экспедиции учтено 475 особей обоих видов.
Южный гигантский буревестник Macronectes giganteus (J.F. Gmelin, 1789). В районе исследований южный гигантский буревестник гнездится на острове Южная Георгия, Южных Оркнейских и Южных Шетландских островах. Общая численность оценивается в 54-47.8 тыс. пар (Patterson et al. 2008). Взрослые птицы, по данным кольцевания и спутниковой телеметрии, остаются в районе гнездования даже вне периода размножения, тогда как неполовозрелые птицы разлетаются широко (Hunter, Brooke 1982; Blanco, Quintana 2014; Hunter 1984; Thiers et al. 2014). Нами южные гигантские буревестники встречались в течение всего маршрута (рис. 9) начиная примерно с 37° ю.ш. На этом участке маршрута белая морфа этого вида не отмечалась.
Северный гигантский буревестник Macronectes halli Mathews, 1912. Ближайшее место, где гнездится этот вид – остров Южная Георгия. Здесь находится колония, насчитывающая 4310 пар. В общей сложности популяция этого вида оценивается в 11800 гнездящихся пар. Во время сезона размножения самцы и самки используют разные кормовые ресурсы: самцы подбирают падаль в колониях тюленей и пингвинов и охотятся в прибрежных водах, в то время как самки в большей степени зависят от пелагических кормов; кормовой разлёт неполовозрелых птиц шире, чем размножающихся (Hunter 1983; Hunter 1984; Gonzalez-Solis et al. 2000; Becker et al. 2002; Gonzalez-Solis, Croxall 2005; Thiers et al. 2014; Quintana, Dell’Arciprete 2002; Patterson, Fraser 2003; BirdLife International 2004). Северный гигантский буревестник (рис. 10) встречался в течение всего маршрута от Монтевидео до пролива Бигль, начиная с 35°30' ю.ш. Капский голубок Daption capense (Linnaeus, 1758). Гнездится на многих островах Антарктиды и субантарктических островах. Основными местами его гнездования являются Антарктический полуостров, Южная Георгия и острова в море Скотия (del Hoyo et al. 1992).
Капский голубок – морской пелагический вид, особенно вне сезона размножения. В период размножения капские голубки кормятся главным образом над холодными водами за пределами континентального шельфа, но могут встречаться и в прибрежных водах. Нами 11 капских голубков (рис. 11) встречены только 15 января 2020 в акватории между Фолклендскими островами и материком, т.е. на самом южном участке данного маршрута.
Голубой буревестник Halobaena caerulea (J.F.Gmelin, 1789). Этот буревестник встречается по всему южному океану; общая численность оценивается в 3 млн. особей (Brooke 2004). В районе исследований вид гнездится в районе мыса Горн и на острове Южная Георгия. Взрослые птицы, видимо, оседлы, а молодые разлетаются на значительные расстояния от колоний (del Hoyo et al. 1992). Нами голубой буревестник встречен 11 января 2020 в прибрежной акватории Южной Америки на широте 41°50' ю.ш.

Рис. 11. Капский голубок Daption capense. Фото Н.Б.Конюхова.
Антарктический прион Pachyptila desolata (Gmelin, 1789), Тонкоклювый прион Pachyptila belcheri (Mathews, 1912). Эти виды можно различить по рисунку оперения на голове, однако небольшой размер птиц, их хаотичный полёт крайне затрудняют их видовое определение в полевых условиях. Порой даже фотографии не позволяют отнести птицу к тому или иному виду, и мы рассматриваем оба этих вида совместно. Нами первые одиночные прионы встречены в начале маршрута, 11 января 2020, над континентальным шельфом (40°39' ю.ш. и 62°04' з.д.). Позже прионы встречались 13-15 января. Наиболее многочисленными они были 15 января во время шторма, когда в поле зрения кормилось до 40 птиц. За всё время этого маршрута встречены 173 птицы.
Атлантический тайфунник Pterodroma incerta (Schlegel, 1863). Гнездится только на острове Гоф в архипелаге Тристан-да-Кунья. В море распространение вида ограничено южной Атлантикой, от восточного побережья Южной Америки до западного побережья Африки (Enticott 1991). Нами атлантический тайфунник встречен над континентальным склоном примерно от 41° до 45° ю.ш. Всего отмечено 9 птиц.
Мягкопёрый тайфунник Pterodroma mollis (Gould, 1844). Гнездится на островах в Южном полушарии: ближайшая к месту наших работ колония находится на островах Тристан-да-Кунья, в том числе Гоф. Нам мягкопёрые тайфунники встречались в течение всего маршрута от Монтевидео до траверза пролива Бигль. Это были как одиночные птицы, так и разреженные группы до 8 особей. Всего на данном участке маршрута было встречено 133 мягкопёрых тайфунников.
Белогорлый буревестник Procellaria aequinoctialis Linnaeus, 1758. Ближайшее к нашему маршруту место гнездование вида – Южная Георгия. В период размножения кормовой разлёт этих буревестников достигает 8 тыс. км. Нами белогорлые буревестники встречались по всему маршруту. Обычно это были одиночные птицы (рис. 12), лишь только раз встречена разреженная стая в 6 птиц. Всего было встречено 132 особи.

Рис. 12. Белогорлый буревестник Procellaria aequinoctialis. Фото Н.Б.Конюхова.
Серый буревестник Ardenna grisea (J.F.Gmelin, 1789). В районе исследований 10-20 тыс. пар серых буревестников гнездится на Фолклендских островах. Нам они встречались над материковым склоном примерно от 41° до 45°30' ю.ш. и в проливе между Фолклендскими островами и материком. Эти буревестники были немногочисленными; всего встречено 10 особей. Пестробрюхий буревестник Ardenna gravis (O’Reilly, 1818). Ближайшим местом гнездования вида является архипелаг Тристан-даКунья, где, включая остров Гоф, гнездится до 8 млн. пар (Carboneras 1992).
Пестробрюхие буревестники (рис. 13) отмечались в течение всего маршрута, но наиболее многочисленными они были 10 января 2020, когда за светлое время суток видели 48 особей из 54 встреченных на этом участке маршрута.

Рис. 13. Пестробрюхий буревестник Ardenna gravis. Фото С.М.Артемьевой.
Плавунчики Phalaropus sp. гнездятся в тундрах Северной Америки и Евразии. Все три вида зимой могут быть встречены в прибрежной акватории Южной Америки. Мы наблюдали 4 плавунчиков 10 января 2020. К сожалению, определить вид этих птиц нам не удалось. Магелланова чайка Leucophaeus scoresbii (Traill, 1823). Эти чайки гнездятся вдоль южного побережья Чили и Аргентины, Огненной Земли и Фолклендских островов колониями, которые редко превышают 200 пар. В Аргентине общая численность размножающейся части популяции составляет около 700 пар (del Hoyo et al. 1996).
Магелланова чайка встречается в основном в прибрежных водах (рис. 14). Одиночная птица встречена только однажды, 14 января 2020, северо-западнее Фолклендских островов.

Рис. 14. Магелланова чайка Leucophaeus scoresbii. Фото Н.Б.Конюхова.

Рис. 15. Речная крачка Sterna hirundo в зимнем оперении. Фото Н.Б.Конюхова.
Речная крачка Sterna hirundo Linnaeus, 1758. Вид гнездится в северном полушарии, а зимует в прибрежных водах Южной Америки и Африки вплоть до их южных оконечностей. Одна птица встречена 10 января 2020 в шельфовых водах Южной Америки (рис. 15).
Чилийский поморник Stercorarius chilensis (Bonaparte, 1857). Численность этого вида оценивается в несколько тысяч пар, которые гнездятся от центрального Чили до южной оконечности Аргентины, хотя разлёт птиц идёт дальше на север: до центрального Перу в Пацифике и до северной Аргентины в Атлантике (del Hoyo et al. 1996). Одиночная птица встречена 10 января в точке 39°02' ю.ш. и 56°21' з.д.
Антарктический поморник Stercorarius antarcticus (Lesson, 1831). Общая численность вида оценивается в 39-42 тыс. особей, из которых 13-14 тыс. пар гнездится (del Hoyo et al. 1996). Антарктический поморник встречается на Антарктическом полуострове и субантарктических островах Атлантического, Индийского и Тихого океанов, зимует вблизи районов размножения. Гнездится на тех островах, где гнездятся другие морские птицы, включая пингвинов. Он хищничает в основном на этих птицах, но может подбирать рыбу, сопровождая рыболовные суда, а также кормиться в море (del Hoyo et al. 1996). Нами этот вид встречен дважды: одна птица 11 января и 2 птицы 12 января 2020 (рис. 16).

Рис. 16. Антарктический поморник Stercorarius antarcticus. Фото С.М.Артемьевой.
Короткохвостый поморник Stercorarius parasiticus (Linnaeus, 1758). Гнездится в северном полушарии, а зимует вплоть до антарктических вод. Нами три одиночных птицы встречены 11 января 2020 в районе с координатами около 42°15' ю.ш.
Всего на этом этапе экспедиции отмечены 25 видов морских птиц, среди которых доминируют представители отряда буревестникообразных. И в конце считаем нужным сказать несколько слов о трёх видах, а именно о магеллановом пингвине Spheniscus magellanicus, голубоглазом баклане Leucocarbo atriceps и южноамериканской крачке Sterna hirundinacea. В предыдущей нашей публикации (Конюхов и др. 2020) мы упоминали, что эти виды были вполне обычными в районе пролива Бигль, а на этом участке экспедиции мы их не встречали. Все эти виды встречены либо в самом проливе Бигль, либо в акватории, примыкающей к входу в него, и не встречались в открытом море, а этот участок маршрута проходил на значительном удалении от берега.
Л и т е р а т у р а
Волков С.В., Коблик Е.А. 2018. Птицы мира: рекомендуемые русские названия видов // http://zmmu.msu.ru/spec/publikacii/neserijnye-izdaniya/pticy-mira-rekom…
Конюхов Н.Б., Мищенко А.Л., Харитонов С.П., Дмитриев А.Е., Артемьева С.М., Мамаев М.С., Пилипенко Г.Ю., Третьяков А.В. 2020. Заметки о птицах атлантического сектора Южного океана, моря Скоша и пролива Дрейка // Рус. орнитол. журн. 29 (1945): 3049-3082.
ACAP. 2009а. ACAP Species Assessment: Wandering Albatross Diomedea exulans.
ACAP. 2009б. ACAP Species Assessment: Southern Royal Albatross Diomedea epomophora.
ACAP. 2009в. ACAP Species Assessment: Northern Royal Albatross Diomedea sanfordi.
ACAP. 2009г. ACAP Species Assessment: Light-mantled Albatross Phoebetria palpebrata.
Becker P.H., Gonzalez-Solis J.; Behrends B., Croxall J.P. 2002. Feather mercury levels in seabirds at South Georgia: Influence of trophic position, sex and age // Marine Ecology Progress Series 243: 261-269.
BirdLife International. 2004. Tracking ocean wanderers: the global distribution of albatrosses and petrels. Cambridge, U.K.
Blanco G., Quintana F. 2014. Differential use of the Argentine shelf by wintering adults and juveniles southern giant petrels, Macronectes giganteus, from Patagonia // Estuarine, Coastal and Shelf Science 149: 151-159.
Brooke M. de L. 2004. Albatrosses and Petrels Across the World. Oxford Univ. Press.
Carboneras C. 1992. Procellariidae (Petrels and Shearwaters) // del Hoyo J., Elliott A., Sargatal J. (eds.) Handbook of the Birds of the World. Barcelona: 216-257. Clements J.F., Schulenberg T.S., Iliff M.J., Roberson D., Fredericks T.A., Sullivan B.L., Wood C.L. 2017.
Clements Checklist of Birds of the World // http://www.birds.cornell. edu /clementschecklist.
Croxall J.P., Gales R. 1998. Assessment of the conservation status of albatrosses // Robertson G., Gales R. (eds.) Albatross biology and conservation. Chipping Norton (Australia): 46-65.
del Hoyo J., Elliot A., Sargatal J. 1992. Handbook of the Birds of the World. Vol. 1. Ostrich to Ducks. Barcelona.
del Hoyo J., Elliott A., Sargatal J. 1996. Handbook of the Birds of the World. Vol. 3. Hoatzin to Auks. Barcelona.
Enticott J.W. 1991. Distribution of the Atlantic Petrel Pterodroma incerta at sea // Marine Ornithology 19: 49-60.
González-Solís J., Croxall J.P. 2005. Differences in foraging behaviour and feeding ecology in giant petrels // Ruckstuhl K.E., Neuhaus P. (eds.) Sexual Segregation in Vertebrates: Ecology of the Two Sexes. Cambridge Univ. Press: 92-111.
González-Solís J., Croxall J.P., Wood A.G. 2000. Foraging partitioning between giant petrels Macronectes spp. and its relationship with breeding population changes at Bird Island, South Georgia // Marine Ecology Progress Series 204: 279-288.
Hunter S. 1984. Movements of South Georgia giant petrels Macronectes spp. ringed at South Georgia // Ringing & Migration 5, 2: 105-112.
Hunter S., Brooke M. de L. 1992. The diet of giant petrels Macronectes spp. at Marion Island, southern Indian Ocean // Colonial Waterbirds 15: 56-65.
Moore P.J., Bettany S.M. 2005. Band recoveries of Southern Royal Albatrosses (Diomedea epomophora) from Campbell Island, 1943-2003 // Notornis 52: 195-205.
Narosky T., Yzurieta D. 2010. Birds of Argentina and Uruguay. A Field Guide. Buenos Aires: 1-427.
Patterson D.L., Fraser W.R. 2003. Satellite tracking Southern Giant Petrels at Palmer Station, Antarctica // Microwave Telemetry, Inc. Newsletter 8: 3-4.
Patterson D.L., Woehler E.J., Croxall J.P., Cooper J., Poncet S., Fraser W.R. 2008. Breeding distribution and population status of the Northern Giant Petrel Macronectes halli and Southern Giant Petrel M. giganteus // Marine Ornithology 36: 115-124.
Poncet S., Robertson G., Phillips R.A., Lawton K., Phalan B.; Trathan P.N., Croxall J.P. 2006. Status and distribution of Wandering, Black-browed and Grey-headed Albatrosses breeding at South Georgia // Polar Biology 29: 772-781.
Quintana F., Dell’Arciprete O.P. 2002. Foraging grounds of southern giant petrels (Macronectes giganteus) on the Patagonian shelf // Polar Biology 25, 2: 159-161.
Shirihai Н. 2008. The Complete Guide to Antarctic Wildlife. Birds and Marine Mammals of the Antarctic Continent and the Southern Ocean. 2nd ed. Princeton Univ. Press: 1-545.
Thiers L., Delord K., Barbraud C., Phillips R.A., Pinaud D., Weimerskirch H. 2014. Foraging zones of the two sibling species of giant petrels in the Indian Ocean throughout the annual cycle: implication for their conservation // Marine Ecology Progress Series 499: 233-248.
Wolfaardt A. 2012. An assessment of the population trends and conservation status of Blackbrowed Albatrosses in the Falkland Islands. Joint Nature Conservation Committee (JNCC), July 2012.
